Por Filipa Seruca1, Hugo Machado1, Ruben Loureiro1& Sheley Castilho1 (Licenciatura em Psicologia, Universidade Autónoma de Lisboa – UC de Neurobiologia II)
Junho 2024
Introdução
A demência é a sétima maior causa de morte, e uma das maiores causas de incapacidade entre as pessoas mais velhas. É caracterizada por um declínio progressivo das funções cognitivas, tendo um grande impacto não só nos indivíduos afetados, mas também nas suas famílias e na sociedade em geral. As formas mais comuns de demência são a doença de Alzheimer e a demência vascular, estando ambas associadas a um declínio significativo na qualidade de vida (World Health Organization, 2023).
Nos últimos anos, têm existido estudos que procuram descobrir tratamentos eficazes para a demência. Uma área de crescente interesse é o uso de substâncias psicadélicas, como a psilocibina, o LSD e o DMT, que têm demonstrado potencial terapêutico em várias condições neurológicas e psiquiátricas (Catlow et al., 2013). Estudos anteriores afirmam que estas substâncias podem promover a neuroplasticidade, reduzir a inflamação cerebral e melhorar a função cognitiva, tornando-se uma opção promissora para intervenções terapêuticas em casos de demência (Ly et al., 2018).
O objetivo deste trabalho é explorar o potencial dos psicadélicos no tratamento da demência com base numa revisão da literatura científica atual. Embora algumas formas de demência possam ser parcialmente tratáveis, grande parte são consideradas incuráveis, destacando a necessidade de investigação contínua e do desenvolvimento de novas abordagens terapêuticas. Iremos abordar aspectos como o que é a demência, o que são os psicadélicos e o seu potencial terapêutico. Analisaremos também os resultados de um questionário feito a 47 participantes sobre o nível de aceitação do uso de psicadélicos para o tratamento de demência.
O que é a demência
A demência é uma doença caracterizada pelo declínio progressivo das funções cognitivas que afeta principalmente a memória, a compreensão, a aprendizagem, o raciocínio lógico, a orientação, e a linguagem. Apesar de não ser considerada parte normal do envelhecimento, a demência afeta maioritariamente pessoas mais velhas, na maioria das vezes afetando drasticamente a rotina de vida do indivíduo, ao ponto de interferir com a sua capacidade de realizar as suas atividades diárias, terminando não só por ser um desafio tanto para o paciente mas também para a sua família e cuidadores.
Tal como com outras doenças neurodegenerativas, como o Parkinson e a Coreia de Huntington, é a degeneração progressiva das células cerebrais que leva à demência (Association, 2016), sendo os tipos de demência mais conhecidos a doença de Alzheimer, a demência Vascular, a demência com Corpos de Lewy e a demência Frontotemporal.
De acordo com a Organização Mundial de Saúde (OMS), em 2023, aproximadamente 55 milhões de pessoas no mundo estão diagnosticadas com demência, sendo que mais de 60% dos diagnósticos correspondem à doença de Alzheimer (Blennow and Zetterberg, 2018).
Apesar de grande parte dos sintomas serem similares, no âmbito clínico é importante diferenciar entre os diferentes tipos da doença, uma vez que o diagnóstico correto pode ajudar a identificar qual o melhor tipo de tratamento para aliviar os sintomas e melhorar a qualidade de vida do indivíduo, podendo envolver abordagens farmacológicas e não farmacológicas.
Doença de Alzheimer
O tipo mais prevalente de demência é a doença de Alzheimer, que se caracteriza principalmente pelo acumular progressivo de placas de beta-amiloide e emaranhados neurofibrilares de proteína tau no cérebro, que levam à degeneração dos neurónios. Tem início frequentemente na região do hipocampo, este tipo de demência começa por afetar esta área do cérebro, responsável pela formação de memórias, antes de se espalhar para outras áreas corticais, sendo um dos primeiros sintomas nos estágios iniciais da doença a limitação de formação de memórias a curto prazo. De seguida, uma das zonas a ser afetada, é normalmente o córtex cerebral, impactando a memória, a linguagem e perceção visual e espacial. Diversos estudos, hoje em dia, demonstram como a doença progride, detalhando o avanço da patologia através de diferentes regiões cerebrais em cada uma das fases, como é o caso do estudo de Jack et al. (2013) onde é fornecido um modelo biomarcador detalhado para os estágios da doença de alzheimer.
Demência Vascular
Por outro lado, a demência vascular é causada por problemas na circulação sanguínea cerebral e resulta de danos nos vasos sanguíneos do cérebro, que impedem o fluxo sanguíneo adequado, podendo resultar de acidentes vasculares cerebrais ou de outros problemas vasculares, levando a episódios de micro e macroangiopatias que afetam principalmente a substância branca e as áreas corticais. Esta condição pode manifestar-se de forma mais abrupta do que a doença de Alzheimer após um evento vascular, ou progressivamente devido a doenças vasculares crónicas, afetando principalmente atenção, planeamento e a função executiva (O’Brien e Thomas, 2015).
Demência com Corpos de Lewy
A Demência com Corpos de Lewy é caracterizada pela de conhecidos como corpos de Lewy, dentro das células cerebrais, no córtex cerebral e em áreas subcorticais, incluindo o tronco cerebral e a substância negra, que é parte do sistema motor. Os sintomas deste tipo de demência podem incluir limitações severas nas capacidades cognitivas, como flutuações na atenção e alerta, alucinações visuais e problemas motores bastante parecidos aos da doença de Parkinson (McKeith et al., 2017).
Demência Frontotemporal
Por fim, a Demência Frontotemporal envolve a degeneração dos lobos frontais e temporais do cérebro. Este tipo de demência afeta maioritariamente a personalidade e o comportamento do indivíduo, incluindo o seu comportamento a nível social, assim como a linguagem e a capacidade de comunicação, uma vez que afeta as regiões do cérebro responsáveis por essas funções (Rascovsky et al., 2011).
Causas, sintomas e tratamento
Como já verificado, a demência resulta de danos ou perda de células cerebrais em diversas partes do cérebro, resultando na morte progressiva das células cerebrais. As causas da demência são variadas, dependendo do tipo específico de demência, mas podem incluir fatores genéticos, como no caso do início precoce da doença de alzheimer e da demência frontotemporal (Bateman et al., 2011), problemas na circulação sanguínea na demência vascular (O’Brien e Thomas, 2015), lesões cerebrais como traumatismos crâneo-encefálicos com manifestações comportamentais (Gardner e Yaffe, 2015) e outros fatores de risco ambientais e de estilo de vida, como exposição a poluentes, fumar e beber álcool, maus hábitos alimentares e falta de exercício físico (Livingston et al., 2020).
Apesar de ser possível identificar quais são as principais causas da demência e ser possível agir em prevenção ou até minimizar os seus sintomas, não existe até à data, uma cura. Desta forma, mantêm-se os esforços de diversos investigadores para o desenvolvimento de novas abordagens terapêuticas. Um desses potenciais tratamentos está ainda em período experimental e envolve a utilização de substâncias psicadélicas, as quais investigamos no presente trabalho.
O que são os psicadélicos e os seus benefícios
Os psicadélicos são uma classe de substâncias psicoativas que induzem alterações na perceção, humor e processos cognitivos. Algumas das substâncias psicadélicas mais conhecidas são a psilocibina, o LSD (dietilamida do ácido lisérgico), a DMT (dimetiltriptamina), a cetamina, o MDMA (metilenodioximetanfetamina) e a mescalina. Estas substâncias atuam principalmente nos receptores de serotonina 5-HT2A que estão abundantemente presentes em áreas do cérebro associadas à cognição, percepção e consciência. Quando ativados, eles desencadeiam uma cascata de eventos neuroquímicos que levam a mudanças nas redes neuronais e na neuroplasticidade (Grieco et al., 2022).
Os psicadélicos podem ser encontrados em várias fontes naturais e também podem ser sintetizados em laboratório. A psilocibina, que é encontrada em cogumelos do género Psilocybe, é convertida em psilocina após a ingestão, sendo esta a responsável pelos efeitos psicadélicos. O LSD, que foi sintetizado pela primeira vez em 1938 por Albert Hofmann, é um derivado semi-sintético do ácido lisérgico encontrado no fungo ergot, que cresce em grãos de centeio e é conhecido pelos seus efeitos de longa duração e alta potência (Grieco et al., 2022). A DMT é um composto natural, presente em várias plantas usadas em práticas tradicionais, como a ayahuasca, provoca experiências intensas mas de curta duração. A mescalina é extraída principalmente do cacto peyote (Lophophora williamsii) e do cacto São Pedro (Echinopsis pachanoi) e tem uma longa história de uso em rituais indígenas na América do Norte e Central (Sumner & Lukasiewicz, 2023). A cetamina, que foi originalmente desenvolvida como anestésico, tem propriedades dissociativas e psicadélicas em microdoses. O MDMA, mais conhecido como ”ecstasy”, foi sintetizado pela primeira vez na década de 1910, tendo ganho popularidade como droga recreativa (Grieco et al., 2022). Os psicadélicos são considerados fisiologicamente mais seguros que outras substâncias devido a terem baixos níveis de toxicidade e baixo potencial de causar dependência (Gable, 2004).
Os psicadélicos estão atualmente a ser estudados, devido aos seus potenciais usos terapêuticos numa grande variedade de condições psiquiátricas e neurológicas. Estudos indicam que estas substâncias podem ser eficazes no tratamento da perturbação de stress pós-traumático, de depressão resistente ao tratamento, ansiedade associada a doenças terminais e dependência de substâncias, como o álcool e tabaco (De Vos et al., 2021).
A prática da microdosagem, que se baseia no consumo de doses muito baixas de psicadélicos, tem despertado interesse na pesquisa científica. As doses típicas variam entre 5 e 10% da dose recreativa total. Estudos anteriores sugerem que a microdosagem pode melhorar a criatividade, a concentração, o bem-estar emocional e a neuroplasticidade sem induzir os efeitos alucinogénicos típicos das doses mais altas (Sumner & Lukasiewicz, 2023).
No contexto da demência, a microdosagem de psicadélicos está a ser investigada devido ao seu potencial para reduzir a inflamação cerebral e promover a neuroplasticidade, que são dois fatores críticos na progressão de doenças neurodegenerativas. Estudos indicam que, mesmo em microdoses, os psicadélicos podem estimular a produção de fatores neurotróficos como o BDNF (Brain Derived Neurotrophic Factor) e o NGF (Nerve Growth Factor), que são fundamentais para a regeneração neuronal (De Vos et. al., 2021).
Estudos em animais e ensaios clínicos iniciais têm obtido resultados promissores. Por exemplo, um estudo (Nardai et al., 2020) com ratos demonstrou que microdoses de DMT e LSD aumentaram a neurogénese no hipocampo, área do cérebro essencial para a memória e a aprendizagem (De Vos et. al., 2021). Ensaios clínicos com microdosagens de psilocibina e LSD estão a ser desenvolvidos para avaliar os seus efeitos em pacientes com demência e outras condições neurodegenerativas, priorizando a segurança, a tolerabilidade e a eficácia a longo prazo (Grieco et al., 2022).
Estudos e resultados sobre Demência VS Psicadélicos
Atualmente, devido ao seu historial como anestésico, apenas a cetamina é utilizada legalmente em Portugal, sendo um fármaco seguro e existindo evidências dos seus efeitos antidepressivos, assim como um grande potencial no tratamento da ansiedade, perturbação de stress pós-traumático, dependência do álcool e perturbações alimentares. No entanto, Portugal está também na linha da frente nos testes com substâncias adicionais, como é o caso da Psilocibina na Fundação Champalimaud, no tratamento de depressão nos cuidados paliativos de doentes com Parkinson (Ramalho, 2024).
Conforme mencionado anteriormente, o aparecimento da doença de Alzheimer está relacionado com os emaranhados neurofibrilares de proteína tau e pelas placas de beta-amiloide. Os emaranhados neurofibrilares são estruturas compostas pela proteína tau anormais presentes nos neurónios de doentes com Alzheimer. Em condições normais, a função da proteína tau é de auxiliar na estabilização dos microtúbulos, essenciais para o transporte de nutrientes e moléculas ao longo dos axónios dos neurónios, fundamentais para a saúde e para a função celular (Iqbal, Liu, & Gong, 2016). Em doentes diagnosticados com doença de Alzheimer, a proteína tau torna-se hiperfosforilada e desagrega-se dos microtúbulos, sendo esta desagregação responsável pela formação dos emaranhados dentro dos neurónios. Os emaranhados neurofibrilares, por sua vez, interrompem o sistema de transporte intracelular, levando à disfunção e morte das células (Grundke-Iqbal et al., 1986), levando então a um declínio cognitivo e à perda de memória característica da doença de Alzheimer (Götz, & Ittner, 2008).
Além dos emaranhados, outra característica da doença de Alzheimer, são as placas de beta-amiloide, depósitos extracelulares encontrados no cérebro de pessoas com doença de Alzheimer, formados por fragmentos de proteína precursora amiloide (APP). Num cérebro saudável, a APP desempenha funções importantes no desenvolvimento e reparo neuronal, bem como na regulação sináptica (Selkoe, 1991), no entanto, na doença de Alzheimer, a APP é processada anormalmente pelas enzimas beta e gama-secretases, acabando por produzir peptídeos beta-amiloide, especialmente Aβ42, que tende a formar agregados (Hardy & Selkoe, 2002). São estes que ao se agregarem formam as placas que se depositam entre os neurónios, interferindo e impedindo uma comunicação celular eficaz e desencadeando respostas inflamatórias. Este é o principal marcador patológico principal da doença de Alzheimer, associado à neurodegeneração progressiva (Querfurth & LaFerla, 2010).
Os psicadélicos têm emergido como substâncias promissoras no tratamento da demência, como a doença de Alzheimer, principalmente devido à sua capacidade de promover a neuroplasticidade e a neuroproteção, uma vez que atuam como agonistas potentes dos receptores de serotonina no cérebro e que a ativação desses receptores tem sido associada a um aumento na expressão de fatores neurotróficos, como o BDNF, que é crucial para a sobrevivência e regeneração neuronal, e no combate à perda neuronal que é uma característica central à doença de Alzheimer. Além disso, os psicadélicos demonstram também potencial para mitigar a inflamação cerebral e o stress oxidativo, uma vez que estes podem exercer efeitos anti-inflamatórios no cérebro, reduzindo a ativação de vias inflamatórias que são exacerbadas na doença (Sinha et al., 2024), protegendo desta maneira contra a perda neuronal e melhorando as funções cognitivas.
Somando aos benefícios já mencionados, acrescem os benefícios na reconfiguração das redes cerebrais, no reforço da conectividade neuronal ao promover a formação de novas sinapses, o fortalecimento das redes neuronais no hipocampo, a indução a plasticidade sináptica e a neurogênese, sendo estes cruciais para contrariar a deterioração funcional causada pela doença de Alzheimer (Sinha et al., 2024).
Método
Foi medido qual é o nível de aceitação dos participantes à ideia dos psicadélicos poderem ser uma solução para o tratamento de demência. Para tal, fizemos um inquérito de opinião, através do Google Forms, com um consentimento informado, onde utilizámos variáveis sociodemográficas, variáveis de opinião com perguntas de “sim” ou “não”, e variáveis de opinião com uma escala de Likert de 1 a 5 valores. Os resultados, que abaixo são especificados, demonstram que, no geral, existe uma tendência da amostra para a aceitação do uso dos psicadélicos para o tratamento da demência, embora com cuidados e reservas em relação ao conhecimento existente, expressando uma necessidade de existirem mais estudos sobre o tema. Concluímos também que, apesar da tendência ir ao encontro da nossa hipótese, de que as pessoas tendem a aceitar o tratamento da demência com psicadélicos, não podemos inferir que a população seguirá esta tendência devido à nossa amostra ser relativamente pequena (N = 47).
Resultados
A nossa amostra conta com 47 participantes, dos quais 18 são do sexo feminino (38.298%), 26 do sexo masculino (55.319%) e 3 preferiram não dizer qual o seu sexo (6.383%). A idade dos participantes da amostra foi calculada em intervalos de classes, nomeadamente dos 18 aos 24 anos (n = 8, 17.021%), 25 aos 34 anos (n = 13, 27.66,%), 35 aos 44 anos (n = 11, 23.404%), 45 aos 54 anos (n = 11, 23.404%), 55 aos 64 anos (n = 1, 6.383%) e 65 ou mais anos (n = 3, 6.383%).
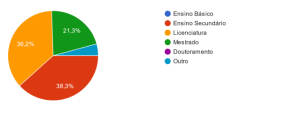
O nível de escolaridade é diverso, sendo que a grande maioria (n = 35, 74.468%) tem o ensino secundário ou uma licenciatura, como é possível de observar na figura 1.
Figura 1
Representação gráfica dos graus de escolaridade dos participantes
Apenas um participante não sabe o que é a demência (n = 1, 2.128%), sendo que a grande maioria sabe o que é (n = 46, 97.872%). 74.468% (n = 35) dos inquiridos já teve contacto com demência, ao invés dos restantes 12 (25.532%). 25 destes participantes (53.191%) tiveram um familiar com esta doença, contrariamente a 22 pessoas da amostra (46.809%)
Em relação aos psicadélicos, 43 participantes (91.489%) sabem o que são, mas apenas 18 (38.298%) tiveram contacto pessoal com estas substâncias. 13 participantes (27.660%) reportaram que conhecem quem teve contacto com as substâncias.
Perguntámos aos participantes que substâncias lhes eram familiares e 38 (80.900%) sabem o que é LSD, 37 (78.800%) sabem o que é MDMA, 32 (68.100%) sabem o que é a Psilocibina, 18 (38.300%) sabem o que é cetamina, 13 (27.700%) reportaram que outras substâncias lhes são familiares e apenas 7 participantes (14.900%) reportaram que nenhum psicadélico lhe é familiar.
Para a medição da nível de aceitação dos participantes em relação aos psicadélicos como solução para o tratamento de demência, utilizámos uma escala de Likert, cotadas de 1 a 5, sendo 1 – Discordo totalmente, 2 – Discordo, 3 – Não concordo nem discordo, 4 – Concordo e 5 -Concordo totalmente.
Dos participantes, 28 (59.575%) acredita que o uso de psicadélicos pode ajudar a melhorar os sintomas de demência, e apenas 5 (10.638%) não acredita nesta solução. 37 participantes (78.724%) estão abertos a considerar tratamentos como os psicadélicos no tratamento da demência, 4 (8.511%) mantêm-se neutros e 6 participantes (12.766%) discordam com esta solução. 30 participantes (63,830%) discorda que os psicadélicos sejam perigosos e que não devem ser utilizados em contexto clínico e 25 participantes (53.192%) acha que os potenciais benefícios dos psicadélicos superam os potenciais riscos no tratamento da demência. De referir que apenas 20 participantes (42.553%) consideram ter conhecimento para considerar esta solução de tratamento como válida. Para um melhor entendimento sobre estes resultados, observe as tabelas abaixo.
Tabela 1
Grau de concordância sobre o uso de psicadélicos na melhoria da demência
| Acredito que o uso de psicadélicos melhora a demência | Frequência | Percentagem | |||
| Discordo totalmente | 2 | 4.255 | |||
| Discordo | 3 | 6.383 | |||
| Não concordo nem discordo | 14 | 29.787 | |||
| Concordo | 16 | 34.043 | |||
| Concordo totalmente | 12 | 25.532 | |||
| Total | 47 | 100.000 | |||
Tabela 2
Grau de concordância relativamente à perigosidade do uso de psicadélicos em contexto clínico
| Os psicadélicos são perigosos, não usar em clínica | Frequência | Percentagem | |||
| Discordo totalmente | 16 | 34.043 | |||
| Discordo | 14 | 29.787 | |||
| Não concordo nem discordo | 10 | 21.277 | |||
| Concordo | 3 | 6.383 | |||
| Concordo totalmente | 4 | 8.511 | |||
| Total | 47 | 100.00 | |||
Tabela 3
Grau de concordância sobre um maior número de benefícios em comparação com os riscos, do potencial uso dos psicadélicos
| Mais benefícios que riscos | Frequência | Percentagem | |||
| Discordo | 4 | 8.511 | |||
| Não concordo nem discordo | 16 | 34.043 | |||
| Concordo | 13 | 27.660 | |||
| Concordo totalmente | 12 | 25.532 | |||
| Discordo totalmente | 2 | 4.255 | |||
| Total | 47 | 100.00 | |||
Apesar desta posição de tendência favorável, os participantes da amostra também demonstram prudência: 24 participantes (51.064%) acha que, apesar de a demência ser uma doença sem cura, não deve ser considerado qualquer tratamento e 4 participantes (8.511%) não concorda nem discorda; 40 participantes (85.107%) acreditam que são necessárias mais investigações sobre o assunto e 41 participantes (87.234%) apoiam esta solução se existirem evidências científicas. 41 participantes (87.234%) consideram que os médicos devem informar os pacientes com demência sobre esta possibilidade, sendo que 4 participantes (8.511%) mantêm-se neutros relativamente a esta questão. Existem também preocupações com possíveis efeitos colaterais em 20 participantes (42.553%), sendo que 15 participantes (31.915%) se mantêm neutros nesta questão.
Conclusão
Este trabalho procurou explorar o potencial terapêutico dos psicadélicos no tratamento da demência, com base numa revisão da literatura científica atual e na análise de um questionário de opinião aplicado a 47 participantes. A evidência científica sugere que substâncias como a psilocibina, o LSD e a DMT podem promover a neuroplasticidade, reduzir a inflamação cerebral e estimular a regeneração neuronal, fatores cruciais no contexto das doenças neurodegenerativas, como a doença de Alzheimer.
A análise da nossa amostra revelou uma tendência global de aceitação da utilização clínica de psicadélicos para o tratamento da demência, ainda que acompanhada por cautela e pela exigência de mais investigação científica. Estes dados refletem uma sociedade em transição, cada vez mais aberta a terapias inovadoras, mas consciente dos riscos éticos, legais e médicos associados.
Apesar da limitação do tamanho da amostra e da natureza exploratória do questionário, este estudo fornece contributos relevantes para o debate emergente sobre o uso de psicadélicos em contextos clínicos. A nossa revisão evidencia que esta abordagem merece ser estudada com maior profundidade, através de ensaios clínicos rigorosos, com amostras mais amplas e critérios metodológicos robustos.
Num cenário de envelhecimento populacional e de ausência de cura para a maioria das demências, os psicadélicos representam uma possível fronteira terapêutica com impacto potencial na saúde pública, na qualidade de vida dos doentes e no paradigma da intervenção neurológica.
Nota do Autor
Este trabalho foi realizado por Filipa Seruca¹, Hugo Machado¹, Ruben Loureiro¹ e Sheley Castilho¹ no âmbito da unidade curricular de Neurobiologia II da Licenciatura em Psicologia da Universidade Autónoma de Lisboa (UAL), no segundo semestre do ano letivo 2024/2025. A conclusão foi redigida a posteriori, por iniciativa do autor Hugo Machado, com base numa reflexão crítica sobre o conteúdo do trabalho.
Referências
Alzheimer’s Disease facts and figures (2024). Alzheimer’s Disease and Dementia. https://www.alz.org/alzheimers-dementia/facts-figures
Bateman, R. J., Xiong, C., Benzinger, T. L., Fagan, A. M., Goate, A., Fox, N. C., Marcus, D. S., Cairns, N. J., Xie, X., Blazey, T. M., Holtzman, D. M., Santacruz, A., Buckles, V., Oliver, A., Moulder, K., Aisen, P. S., Ghetti, B., Klunk, W. E., McDade, E., Morris, J. C. (2012). Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. New England Journal of Medicine, 367(9), 795–804. https://doi.org/10.1056/nejmoa1202753
Belser, A. B., Agin-Liebes, G., Swift, T. C., Terrana, S., Devenot, N., Friedman, H. L., Guss, J., Bossis, A., Ross, S. (2017). Patient Experiences of Psilocybin-Assisted Psychotherapy: An Interpretative Phenomenological analysis. Journal of Humanistic Psychology, 57(4), 354–388. https://doi.org/10.1177/0022167817706884
Bogenschutz, M. P., Forcehimes, A. A., Pommy, J. A., Wilcox, C. E., Barbosa, P., Strassman, R. J. (2015). Psilocybin-assisted treatment for alcohol dependence: A proof-of-concept study. Journal of Psychopharmacology, 29(3), 289–299. https://doi.org/10.1177/0269881114565144
Buckner, R. L., Andrews‐Hanna, J. R., Schacter, D. L. (2008). The brain’s default network. Annals of the New York Academy of Sciences, 1124(1), 1–38. https://doi.org/10.1196/annals.1440.011
Carbonaro, T. M., Bradstreet, M. P., Barrett, F. S., MacLean, K. A., Jesse, R., Johnson, M. W., Griffiths, R. R. (2016). Survey study of challenging experiences after ingesting psilocybin mushrooms: Acute and enduring positive and negative consequences. Journal of Psychopharmacology, 30(12), 1268–1278. https://doi.org/10.1177/0269881116662634
Carhart-Harris, R. L., Erritzoe, D., Williams, T., Stone, J. M., Reed, L. J., Colasanti, A., Tyacke, R. J., Leech, R., Malizia, A. L., Murphy, K., Hobden, P., Evans, J., Feilding, A., Wise, R. G., Nutt, D. J. (2012b). Neural correlates of the psychedelic state as determined by fMRI studies with psilocybin. Proceedings of the National Academy of Sciences of the United States of America, 109(6), 2138–2143. https://doi.org/10.1073/pnas.1119598109
Carhart-Harris, R. L., Muthukumaraswamy, S., Roseman, L., Kaelen, M., Droog, W., Murphy, K., Tagliazucchi, E., Schenberg, E. E., Nest, T., Orban, C., Leech, R., Williams, L. T., Williams, T. M., Bolstridge, M., Sessa, B., McGonigle, J., Sereno, M. I., Nichols, D., Hellyer, P. J., Nutt, D. J. (2016). Neural correlates of the LSD experience revealed by multimodal neuroimaging. Proceedings of the National Academy of Sciences of the United States of America, 113(17), 4853–4858. https://doi.org/10.1073/pnas.1518377113
Carhart-Harris, R.L. et al. (2014). How Do Hallucinogens Work on the Brain?. Psychologist 27, no. 9: 662–65.
Catlow, B. J., Song, S., Paredes, D. A., Kirstein, C. L., Sanchez-Ramos, J. (2013b). Effects of psilocybin on hippocampal neurogenesis and extinction of trace fear conditioning. Experimental Brain Research, 228(4), 481–491. https://doi.org/10.1007/s00221-013-3579-0
Cohen, S. (1960). Lysergic Acid Diethylamide. The Journal of Nervous and Mental Disease, 130(1), 30–40. https://doi.org/10.1097/00005053-196001000-00005
Cohen, S. (1964). The Beyond Within: The LSD Story. New York: Atheneum. https://archive.org/details/beyondwithinlsds0000cohe
Cohen, S. (1965, September 1). LSD and the anguish of dying. Harper’s Magazine. https://harpers.org/archive/1965/09/lsd-and-the-anguish-of-dying/
Cohen, S. (1966). A classification of LSD complications. Psychosomatics, 7(3), 182–186. https://doi.org/10.1016/s0033-3182(66)72149-5
Gable, R. S. (2004). Comparison of acute lethal toxicity of commonly abused psychoactive substances. Addiction,99(6), 686–696. https://doi.org/10.1111/j.1360-0443.2004.00744.x
Gardner, R. C., Yaffe, K. (2015). Epidemiology of mild traumatic brain injury and neurodegenerative disease. Molecular and Cellular Neurosciences, 66, 75–80. https://doi.org/10.1016/j.mcn.2015.03.001
Götz, J., Ittner, L. M. (2008). Animal models of Alzheimer’s disease and frontotemporal dementia. Nature Reviews. Neuroscience, 9(7), 532–544. https://doi.org/10.1038/nrn2420
Grieco, S. F., Castrén, E., Knudsen, G. M., Kwan, A. C., Olson, D. E., Zuo, Y., Holmes, T. C., Xu, X. (2022). Psychedelics and Neural Plasticity: therapeutic implications. The Journal of Neuroscience, 42(45), 8439–8449. https://doi.org/10.1523/jneurosci.1121-22.2022
Grundke-Iqbal, I., Iqbal, K., Tung, Y. C., Quinlan, M., Wisniewski, H. M., Binder, L. I. (1986). Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proceedings of the National Academy of Sciences of the United States of America, 83(13), 4913–4917. https://doi.org/10.1073/pnas.83.13.4913
Hardy, J., Selkoe, D. J. (2002). The Amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics. Science, 297(5580), 353–356. https://doi.org/10.1126/science.1072994
Iqbal, K., Liu, F., & Gong, C. (2015). Tau and neurodegenerative disease: the story so far. Nature Reviews. Neurology, 12(1), 15–27. https://doi.org/10.1038/nrneurol.2015.225
Jack, C. R., Knopman, D. S., Jagust, W. J., Petersen, R. C., Weiner, M. W., Aisen, P. S., Shaw, L. M., Vemuri, P., Wiste, H. J., Weigand, S. D., Lesnick, T. G., Pankratz, V. S., Donohue, M. C., Trojanowski, J. Q. (2013). Tracking pathophysiological processes in Alzheimer’s disease: an updated hypothetical model of dynamic biomarkers. Lancet Neurology, 12(2), 207–216. https://doi.org/10.1016/s1474-4422(12)70291-0
Liechti, M. E. (2017). Modern Clinical research on LSD. Neuropsychopharmacology, 42(11), 2114–2127. https://doi.org/10.1038/npp.2017.86
Livingston, G., Huntley, J., Sommerlad, A., Ames, D., Ballard, C., Banerjee, S., Brayne, C., Burns, A., Cohen-Mansfield, J., Cooper, C., Costafreda, S. G., Dias, A., Fox, N., Gitlin, L. N., Howard, R., Kales, H. C., Kivimäki, M., Larson, E. B., Ogunniyi, A., Mukadam, N. (2020). Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet, 396(10248), 413–446. https://doi.org/10.1016/s0140-6736(20)30367-6
Ly, C., Greb, A. C., Cameron, L. P., Wong, J. M., Barragan, E. V., Wilson, P. C., Burbach, K. F., Zarandi, S. S., Sood, A., Paddy, M. R., Duim, W. C., Dennis, M. Y., McAllister, A. K., Ori-McKenney, K. M., Gray, J. A., Olson, D. E. (2018). Psychedelics promote structural and functional neural plasticity. Cell Reports, 23(11), 3170–3182. https://doi.org/10.1016/j.celrep.2018.05.022
McKeith, I. G., Boeve, B. F., DIckson, D. W., Halliday, G., Taylor, J. P., Weintraub, D., Aarsland, D., Galvin, J., Attems, J., Ballard, C. G., Bayston, A., Beach, T. G., Blanc, F., Bohnen, N., Bonanni, L., Bras, J., Brundin, P., Burn, D., Chen-Plotkin, A., Kosaka, K. (2017). Diagnosis and management of dementia with Lewy bodies. Neurology, 89(1), 88–100. https://doi.org/10.1212/wnl.0000000000004058
Nardai, S., László, M., Szabó, A., Alpár, A., Hanics, J., Zahola, P., Merkely, B., Frecska, E., Nagy, Z. (2020). N,N-dimethyltryptamine reduces infarct size and improves functional recovery following transient focal brain ischemia in rats. Experimental Neurology, 327, 113245. https://doi.org/10.1016/j.expneurol.2020.113245
O’Brien, J. T., Thomas, A. (2015). Vascular dementia. Lancet, 386(10004), 1698–1706. https://doi.org/10.1016/s0140-6736(15)00463-8
Petri, G., Expert, P., Turkheimer, F., Carhart-Harris, R., Nutt, D., Hellyer, P. J., Vaccarino, F. (2014). Homological scaffolds of brain functional networks. Journal of the Royal Society Interface, 11(101), 20140873. https://doi.org/10.1098/rsif.2014.0873
Querfurth, H. W., LaFerla, F. M. (2010). Alzheimer’s Disease. New England Journal of Medicine, 362(4), 329–344. https://doi.org/10.1056/nejmra0909142
Ramalho, T. (2024, January 24). Portugal vai testar psicadélicos no tratamento da depressão em cuidados paliativos. PÚBLICO. https://www.publico.pt/2024/01/24/ciencia/noticia/portugal-vai-testar-psicadelicos-tratamento-depressao-cuidados-paliativos-2077937
Rascovsky, K., Hodges, J. R., Knopman, D., Mendez, M. F., Kramer, J. H., Neuhaus, J., Van Swieten, J. C., Seelaar, H., Dopper, E. G. P., Onyike, C. U., Hillis, A. E., Josephs, K. A., Boeve, B. F., Kertesz, A., Seeley, W. W., Rankin, K. P., Johnson, J. K., Gorno-Tempini, M., Rosen, H., Miller, B. L. (2011). Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain, 134(9), 2456–2477. https://doi.org/10.1093/brain/awr179
Selkoe, D. J. (1991). The molecular pathology of Alzheimer’s disease. Neuron, 6(4), 487-498. https://doi.org/10.1016/j.nic.2011.11.003
Sumner, R., Lukasiewicz, K. (2023). Psychedelics and neural plasticity. BMC Neuroscience, 24(1). https://doi.org/10.1186/s12868-023-00809-0
World Health Organization (2023, March 15). Dementia. https://www.who.int/news-room/fact-sheets/detail/dementia